国立研究開発法人情報通信研究機構
2016年11月15日
ポイント
- 自然界にある生物分子モーターに別の機能モジュールを融合し、新しい分子モーターを創出
- 本来の結合相手である微小管ではなく、アクチン繊維と結合して動く新しい分子マシンを構築
- 運動方向の異なるモーターも作製可能であり、新たな分子デバイスの開発につながる成果
NICTでは、生物進化の成果に学び新しい情報通信のパラダイムの創出につながるバイオICT研究を行っています。
未来ICT研究所の古田 健也 主任研究員らの研究グループは、世界で初めて、人為的な設計によって新たな生物分子モーターを創り出すことに成功しました。これは、生物分子モーターの一種であるダイニンの基本構造をベースに、自然界に存在する別の機能モジュールを融合することで実現したものです。さらに、その運動の方向性が逆転した分子モーターの作製にも成功しました。この結果は、ナノメートルスケールでは避けることができない激しい熱運動の中でも効率的に機能する人工的な分子マシンの設計原理として利用されることが期待されます。
なお、本成果は、「Nature Nanotechnology」 2016年11 月14日オンライン速報版(日本時間11月15日(火)午前1:00)に発表されます。
背景
細胞の中で働くタンパク質は、数~数十ナノメートル程の大きさであり、周囲の分子による激しい熱運動にさらされています。この状況においても、細胞内の物質輸送を担う生物分子モーターは、高い効率で自律的に一方向の運動を行うことができます。この原理は、自律的に動く分子マシンの構築に欠かせない情報であるため、力学的な計測や分子構造の解析など、様々な方法によって精力的な研究が世界中で進められてきました。これまでに、既存の生物分子モーターを分析することによって、個々の生命活動に適した構造や機能に対する理解は大きく進みましたが、ナノメートルスケールにおける一方向性運動を生み出す本質的な要素を明らかにすることは未解決の課題でした。
今回の成果
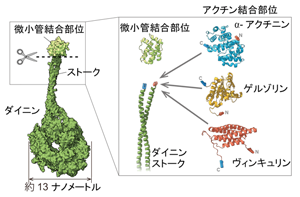
今回、既知の機能モジュールを順次組み合わせていく構成的手法を採り、生物分子モーターの一種、ダイニンをベースとして、これに、本来の微小管と結合するモジュールではなく、アクチン繊維に結合するアクチン結合タンパク質モジュールを融合しました。その結果、本来の結合相手ではないアクチン繊維と結合して、これを一方向に運動させる能力が発現することが分かりました。さらに、これらの機能モジュールの組み合わせ方を変えることで、運動方向を逆転させることができることを発見しました。
今後の展望
ナノメートルサイズの生物分子モーターの一方向運動を、モジュールの組み合わせで実現できたことによって、熱運動の下での運動創出の原理に迫ることができました。この原理は、タンパク質だけではなく、有機材料などのナノ材料にも応用が期待できるので、新たな分子マシンの設計や構築に役立つ可能性があります。
Nature Nanotechnology(DOI: 10.1038/NNANO.2016.238)
2016年11月14日 オンライン速報版
掲載論文名: Creating biomolecular motors based on dynein and actin-binding proteins
著者: Furuta, A., Amino, M., Yoshio, M., Oiwa, K., Kojima, H., Furuta, K.
古田 茜、網野 美紗子、吉雄 麻喜、大岩 和弘、小嶋 寛明、古田 健也(NICT)
研究支援
本研究成果の一部は以下の助成を受けています。
- 文部科学省 科研費 JP22770164
- 独立行政法人日本学術振興会 科研費 JP26440089
- 公益財団法人武田科学振興財団
補足資料
機能モジュールを組み上げることで構築した新規分子モーターに関する詳細資料
背景と目的
今年のノーベル化学賞を受賞した分子マシンの開発は、優れた有機合成技術を駆使して動きや力を発生する分子サイズのマシンを作る技術開発であり、将来的に様々な分野での応用展開が期待されています。一方で、自然に目を向けると、生物は数十億年の進化の歴史を経て、既に多種多様な分子マシンを手に入れていることに気付きます。その中の一つがATP(アデノシン三リン酸)加水分解酵素という分子マシンです。これは、ATPという化学物質の加水分解に伴う自由エネルギー変化を光の発生、運動や力の発生などに変換する驚異的に高機能なタンパク質マシンです。生物分子マシンの駆動原理は、人工的な分子マシンを構築する際に多くの知見をもたらすはずであり、最良の教師であるということができます。私たちは、その中でも生物分子モーターと呼ばれるATP加水分解酵素に着目してその運動メカニズムを明らかにしてきました。
これらの分子マシンは、これまで世界中の研究室で様々な角度から精力的に分析されてきました。その結果、生命の持つ分子マシンが巧妙な機械的な仕組みを持つこと、例えば、小さな構造変化を大きく拡大するテコを持つことや、立体特異的に相互作用相手と結合すること、ATP加水分解サイクルと巧妙に共役することでエネルギー変換効率を著しく高めていることなどが明らかにされてきました。このような知見は、将来の分子マシン構築に向けたアイディアの宝庫となっていますが、運動や力発生の最も基本的な部分、つまり、ナノメートルスケールでは避けることのできない激しい熱運動の嵐の中で、いかに方向性のある運動を作り出すのか、という分子マシン構築の最も基本となる設計原理は、明らかになっていませんでした。
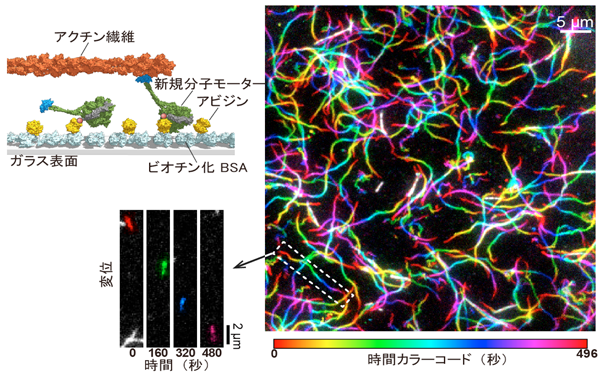
図1 (左)ガラス面に固定された新規分子モーターが、蛍光染色されたアクチン繊維を動かす様子を描いた模式図
(右)この様子を上から蛍光顕微鏡で撮影した動画を加工し、時間ごとに異なる色を付けてから、すべてのフレームを重ね合わせたもの。アクチン繊維が分子モーターによって駆動されると、虹色の軌跡を描くように見える。
(左下)右の画像上で点線で示した部分から幾つかのフレームを抜き出し、連続写真にしたもの。色を付けた短いアクチンが動いていく様子が分かる。
真核生物の細胞内の物質輸送を担う生物分子モーターは、周囲の分子による激しい熱運動にさらされている状況でも高い効率で一方向の運動を行うことができます。生物分子モーターは、エネルギー源であるATPを加水分解して、この反応に共役した大きな構造変化を起こし、一方向性の運動を作り出すとされています。この運動機能の原理の解明を目指して、分析的な方法によって様々な角度から研究が進められてきました。しかし、進化を通じて多様な機能を獲得してきた既存の生物分子モーターを分析する研究だけでは、個別の生命活動に適した構造や機能を理解することはできても、ナノメートルスケールにおける一方向性の運動の本質に迫ることは容易ではありませんでした。この基本原理を明らかにするためには、既存の生物分子モーターの分析に加えて、単純な機能を持つ要素を組み合わせることによって目的とする機能(この場合は運動)を創り出すような構成的な研究手法が効果的です。
私たちは、分子モーターのメカニズムを3つの要素の集合と捉えました。1つ目は、レールとなる繊維タンパク質(微小管やアクチン)との立体特異的な結合部位を持つこと、2つ目は、ATP加水分解能を使って適切なタイムスケールで結合・解離を繰り返すこと、3つ目は、この結合・解離のプロセスに関してフィラメントの一方へバイアスを持つことです。これらの3つの要素を実現できる機能モジュールを自然界に数多く存在するものの中から選び、そのいくつかの要素を組み合わせることによって、ナノメートルサイズの分子モーターが激しい熱運動の中で一方向性の運動を生み出す原理に迫りました。
研究成果
今回、上記の3つの要素について、ATP加水分解機能と構造変化は、生物分子モーターの一種、ダイニンを用いました。ダイニンは、生物分子モーターとしての基本要素、レールとの立体特異的結合、ATP加水分解に伴う結合・解離、フィラメントの一方へバイアスの3要素を有する分子マシンです。ダイニンが明確なモジュール構造を持っているので、私たちは、これらの要素を切り出して別の機能モジュールに置き換えることが可能であると考えました。
そこで、微小管との結合部位を、ダイニンとは無関係な「アクチン結合タンパク質」モジュールと置き換えました。もし、微小管との結合部位がATPを加水分解する本体部分と密接に連携する必要があるならば、アクチン結合部位に置き換えたところで、運動能を失うであろうと予想されました。ところが、予想に反してこの新規分子モーターはアクチン繊維を滑らかに一方向に動かすことができたのです。
したがって、今回の結果は、自然が創り出した機能モジュールを人為的に組み合わることによって、新たな分子マシンを構築できたことを示しており、このことは、生物分子モーターの作動原理として従来想像されていたよりもシンプルな原理の存在をうかがわせます。
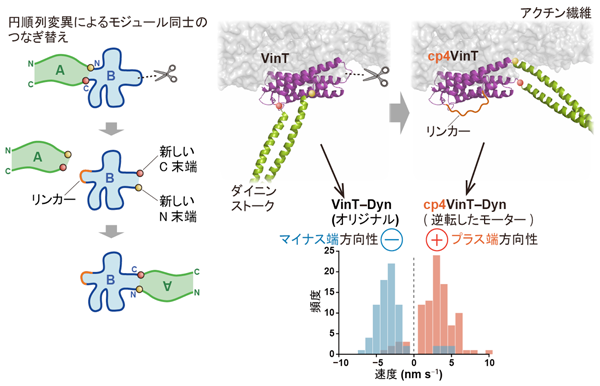
図2 (左)円順列変異によるモジュールのつなぎ替えを説明した図
(右)アクチン結合を担う機能モジュール(紫色)に円順列変異を適用し、ダイニンとのつなぎ方を変えたものを作製したところ、その運動方向が逆転したことを示している。
さらに、私たちは、これらの機能モジュールの組み合わせ方を変えることで、運動方向性を自在に変えることができることを発見しました。具体的には、機能モジュールの組み合わせ方を変えるために、円順列変異という技術をアクチン結合タンパク質に適用し、ダイニンモジュールとアクチン結合タンパク質モジュールのつなぎ方をランダムに変えるという手法を開発しました。その結果、組み合わせ方によっては、元々の運動方向性が逆転し、アクチン上を元の分子モーターとは逆方向に運動するモーターに変換できることを示しました。この運動方向性と、モジュールの組み合わせ方の間の対応関係を調べることにより、分子モーターの運動方向を決める機構に関して新たな知見を得ました。
今回得られた情報から、私たちは、生物分子モーターが熱運動を抑え込むより、むしろ駆動源として利用しており、熱運動をうまく一方向に整流して運動を実現しているというメカニズムを提案しました。
今後の展望
生物が使用している分子マシンは、ナノメートルスケールという極めて小さな世界に存在するため熱運動の嵐の中でも頑強に作動するという、人工の機械とは異なる特長を備えていますが、その設計原理は、いまだに謎に包まれており、本研究は、その解明に向けた大きな一歩であるといえます。将来的には、人為的に制御できる自律型の分子マシンの設計原理を理解することにより、生体親和性の高いアクチュエータ(例えば人工筋肉)や、生物を模倣した新しい情報処理デバイスを開発することにつながると考えられます。
用語解説
生物の運動の原動力となっているタンパク質。ATP(アデノシン三リン酸)を加水分解したときに得られるエネルギーを使って、後述する微小管やアクチン繊維などの輸送路となるタンパク質繊維の上を運動することができる。生物分子モーターには、大きく分けて3種類が存在し、筋肉の収縮の原動力であるミオシン、細胞内の物質輸送に関わるキネシン、物質輸送と繊毛・鞭毛の運動を作り出すダイニンがある。NICTでは、このダイニンに関する研究で多くの成果を挙げている。

ダイニンの模式図
細胞質で働く生物分子モーターの一種で、微小管上を運動するタンパク質複合体。リング状の頭部を持ち、微小管と結合する部位がそのリングから飛び出ていて、明確なモジュール構造になっていることが特徴。ATP加水分解に共役した大きな構造変化が一方向性の運動に重要であると考えられている。
細胞の形や運動に関わる真核生物の細胞内に存在するタンパク質繊維で、チューブリンというユニットが重合してできたチューブ状の細胞骨格である。チューブリンが重合したり脱重合したりすることで、動的にその構造を変化させることが知られている。キネシンやダイニンという生物分子モーターと共に染色体を分離するための紡錘体を形成したり、細胞内の物質輸送、鞭毛繊毛運動や上皮細胞の形やその組織形成など多岐にわたる生命活動にかかわる。
アクチンフィラメントとも呼ばれる、細胞の形や運動に関わる細胞内のタンパク質繊維で、真核生物の細胞内でネットワーク構造を作っている。筋肉を構成する筋細胞内では、ミオシン繊維と滑り合うことで筋収縮を行っている。このアクチン繊維上を運動する分子モーターや後述するアクチン結合タンパク質によって、細胞内輸送や、細胞運動・形の制御など、細胞の動的な性質が決まっている。
真核細胞内でアクチン繊維やアクチン単量体に結合し、アクチン繊維の伸長・短縮のダイナミクスを調節したり、アクチンの3次元的なネットワークの形を決めたりする重要なタンパク質。本研究では、アクチン繊維とのインターフェースとして、それ自身では運動能を持たず単にアクチン繊維に結合するアクチン結合タンパク質を使用している。
本件に関する問い合わせ先
未来ICT研究所
フロンティア創造総合研究室
フロンティア創造総合研究室
古田 健也
Tel: 078-969-2214
E-mail: 


E-mail: 


広報
広報部 報道室
廣田 幸子
Tel: 042-327-6923
Fax: 042-327-7587
E-mail: