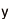国立研究開発法人情報通信研究機構
2015年10月27日
ポイント
- 分裂酵母細胞を使って、低栄養環境にさらされた細胞の示す適応状態を解析
- 低栄養下では、リボソームタンパク質遺伝子発現が特異的に低下していたことを発見
- 生物の効率的なリソース配分の仕組みをネットワークなど社会インフラへ応用することに期待
NICT 未来ICT研究所は、分裂酵母細胞を増殖可能なぎりぎりの低窒素環境で培養したときの遺伝子発現レベルの変動を、独自に改良した高精度のDNAマイクロアレイ実験によって高精度な計測を行い、リボソームタンパク質遺伝子の発現レベルの割合が培養環境に応じて変動することを発見しました。
リボソームは、細胞にとってタンパク質を作るための「工場」のような存在です。細胞内のタンパク質はすべてリボソームという工場で作られますが、リボソーム自身もタンパク質なので、リボソームで作られます。したがって、細胞は、リボソームで「リボソームタンパク質(工場に相当)を作るか」、「非リボソームタンパク質(製品に相当)を作るか」、その配分を決めなくてはなりません。今回の発見から、細胞は、栄養が豊かなときは大量の「工場」を作りますが、栄養が減少しリソースが減少すると、「工場」を大きく減少させ「製品」を小さく減少させることで、その配分比率を変え、タンパク質合成に必要なリソースの節約と細胞の増殖を両立させていることが明らかになりました。
この知見は、生物が環境適応する過程において、限られたリソースを効率よく配分し、増殖を自律的に最適化する能力の一端を明らかにしたものです。リソースが減少したときに、それを効率的に配分する生物の仕組みの理解は、災害時等における電力や電話回線、インターネットなどのリソースを効率的に配分するシステムの開発につながるものと期待されます。
本研究は、大阪大学大学院情報科学研究科 村田正幸教授らとの共同研究によるものです。なお、本研究成果は、2015年10月21日に国際科学誌「Scientific Reports」オンライン速報版で公開されました。
リボソームは、細胞にとってタンパク質を作るための「工場」のような存在です。細胞内のタンパク質はすべてリボソームという工場で作られますが、リボソーム自身もタンパク質なので、リボソームで作られます。したがって、細胞は、リボソームで「リボソームタンパク質(工場に相当)を作るか」、「非リボソームタンパク質(製品に相当)を作るか」、その配分を決めなくてはなりません。今回の発見から、細胞は、栄養が豊かなときは大量の「工場」を作りますが、栄養が減少しリソースが減少すると、「工場」を大きく減少させ「製品」を小さく減少させることで、その配分比率を変え、タンパク質合成に必要なリソースの節約と細胞の増殖を両立させていることが明らかになりました。
この知見は、生物が環境適応する過程において、限られたリソースを効率よく配分し、増殖を自律的に最適化する能力の一端を明らかにしたものです。リソースが減少したときに、それを効率的に配分する生物の仕組みの理解は、災害時等における電力や電話回線、インターネットなどのリソースを効率的に配分するシステムの開発につながるものと期待されます。
本研究は、大阪大学大学院情報科学研究科 村田正幸教授らとの共同研究によるものです。なお、本研究成果は、2015年10月21日に国際科学誌「Scientific Reports」オンライン速報版で公開されました。
背景
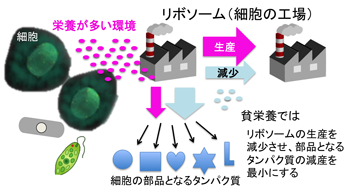
図1 栄養悪化時にリソースを節約する細胞の仕組み
NICT 未来ICT研究所 バイオICT研究室では、生物に学ぶICT技術開発に向けて研究開発を行っており、そのための基盤的取組として、細胞の持つ優れたセンシング能力を活用する技術の構築を目指した研究開発を行っています。
細胞が行う情報処理の中で、環境に応じた遺伝子の発現レベルの調節は、システム全体の中核をなしています。したがって、自律的な情報処理システムを細胞に学ぶ上で、遺伝子の発現レベルを正確に計測することは、不可欠な技術です。現在では、DNAマイクロアレイなど、全遺伝子の発現レベルの計測が可能な技術を使用して、様々な生物種における多様な状態の細胞の遺伝子発現レベルの計測が行われています。こうしたゲノムワイドな計測技術の進展によって、遺伝子発現レベルをより巨視的、包括的に記述する試みも生まれつつあります。しかし、従来、ゲノムワイドな計測では、低発現遺伝子の検出の精度を向上させる研究が多く、比較的容易に検出される高発現遺伝子の計測精度がおろそかにされる傾向にありました。
細胞の示す全遺伝子発現レベルの巨視的、包括的な記述を進める上では、遺伝子発現全体の半分以上を占める高発現遺伝子こそ、高精度に計測する必要がありました。
今回の成果
本研究では、DNAマイクロアレイ実験の条件を検討し、試料調整法や各反応の条件を最適化することにより、高発現域の遺伝子レベルの計測精度を向上させることに成功しました。その条件を用いて、富栄養環境から貧栄養環境へ移行したときの遺伝子発現レベルの変動の計測を行い、細胞が有する自律的な制御機構の一端として、リソースが減少したときの節約の仕組み(栄養が少ないときはリボソーム合成を優先的に減少させること)を明らかにしました(成果の詳細は補足資料参照)。
(1)DNAマイクロアレイ実験条件を検討し、高発現遺伝子レベルの計測精度を向上させた。
DNAマイクロアレイ実験条件を検討し、試料調整法や各反応の条件を最適化することで、高発現遺伝子レベルの計測精度の向上を図りました。これにより、これまで、単に、高発現遺伝子群と思われていたものから、「超高発現遺伝子群」と呼ぶべき遺伝子グループの存在が明らかになりました。
DNAマイクロアレイ実験条件を検討し、試料調整法や各反応の条件を最適化することで、高発現遺伝子レベルの計測精度の向上を図りました。これにより、これまで、単に、高発現遺伝子群と思われていたものから、「超高発現遺伝子群」と呼ぶべき遺伝子グループの存在が明らかになりました。
(2)細胞内のすべての遺伝子に対してmRNAの量を調べたところ、リボソームタンパク質遺伝子から発現するmRNAの量は、ほかの遺伝子に比べて極めて高い値を取ることを発見した。
新たに見いだされた「超高発現遺伝子群」は、mRNAの分布において、これまで報告されていなかったピークを形成しており、このピークには、主としてリボソームタンパク質遺伝子が含まれていました。
新たに見いだされた「超高発現遺伝子群」は、mRNAの分布において、これまで報告されていなかったピークを形成しており、このピークには、主としてリボソームタンパク質遺伝子が含まれていました。
(3)低窒素環境での分裂酵母細胞の増殖
分裂酵母細胞を増殖可能なぎりぎりの低窒素環境で連続培養し、その細胞状態を高窒素環境で培養した場合と比較しました。その結果、細胞は、低窒素に応じて、やせる(減量する)ことで増殖の低下を最小限に食い止めようとしていることが示唆されました。
分裂酵母細胞を増殖可能なぎりぎりの低窒素環境で連続培養し、その細胞状態を高窒素環境で培養した場合と比較しました。その結果、細胞は、低窒素に応じて、やせる(減量する)ことで増殖の低下を最小限に食い止めようとしていることが示唆されました。
(4)低窒素環境で培養した細胞では、リボソームタンパク質遺伝子のレベルが低下していた。
栄養源である窒素を少なくすると、通常は全体の46%以上を占めるリボソームタンパク質の発現量が、5割程度減少していました。その他の遺伝子も減少していましたが、リボソームと比べると少ない減少量でした。これは、栄養源の大量消費者であるリボソームの生産を抑制することによって、ほかのタンパク質の生産を確保しようとする仕組みであると考えられます。また、細胞は、リボソームタンパク質と非リボソームタンパク質の合成割合を変動させることで、限られた窒素を有効に利用する仕組みを有していることを示しています。
栄養源である窒素を少なくすると、通常は全体の46%以上を占めるリボソームタンパク質の発現量が、5割程度減少していました。その他の遺伝子も減少していましたが、リボソームと比べると少ない減少量でした。これは、栄養源の大量消費者であるリボソームの生産を抑制することによって、ほかのタンパク質の生産を確保しようとする仕組みであると考えられます。また、細胞は、リボソームタンパク質と非リボソームタンパク質の合成割合を変動させることで、限られた窒素を有効に利用する仕組みを有していることを示しています。
今後の展望
今回の発見は、細胞が、自らの置かれた環境をセンシングし、自律的にリソース配分を最適化する機構解明に道を開くものであり、災害時等における電力や電話回線、インターネットなどのリソースを効率的に配分するシステムの開発にもつながる柔軟な情報通信システムへの応用が期待されます。
掲載誌: Scientific Reports(Nature Publishing Group), DOI: 10.1038/srep15617
掲載論文名: Cellular economy in fission yeast cells continuously cultured with limited nitrogen resources
著者名: Yuji Chikashige, Shin'ichi Arakawa, Kenji Leibnitz, Chihiro Tsutsumi, Chie Mori, Hiroko Osakada, Masayuki Murata, Tokuko Haraguchi & Yasushi Hiraoka
補足資料
今回の発見の概要
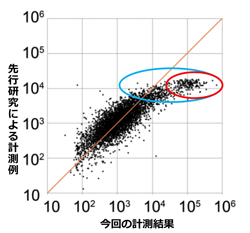
図3 各遺伝子のmRNAレベルの相対値比較
(1)DNAマイクロアレイ実験条件を検討し、高発現遺伝子レベルの計測精度を向上させた。
DNAマイクロアレイ実験条件を検討し、高発現遺伝子レベルの計測精度の向上を図った。図3は、各遺伝子のmRNAレベルの相対値を、縦軸にデータベースに登録されている先行研究による計測例、横軸に今回の我々の計測結果を取り、比較したものである。縦軸では、発現レベルが104程度までしか測定できていないのに対し(104より上の値が検出されていないことから分かる)、横軸では106近くまでを計測できている。この結果、従来、高発現遺伝子群とみなされていた領域(図3青で囲んだ遺伝子群)に、「超高発現遺伝子群」と呼ぶべき遺伝子集団(図3赤で囲んだ遺伝子群)が存在することが明らかになった。
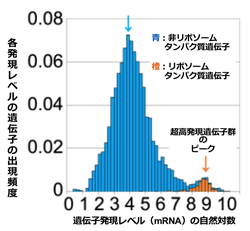
図4 高発現域に見つかった遺伝子群のピーク(橙色)
(2)細胞内のすべての遺伝子に対してmRNAの量を調べたところ、リボソームタンパク質遺伝子から発現するmRNAの量は、ほかの遺伝子に比べて極めて高い値を取ることを発見した。
(1)で計測された「超高発現遺伝子群」は、図4に示す遺伝子発現レベルの分布を表すヒストグラムでは、その他の遺伝子群から成る中央付近の大きなピーク(青色矢印↓で示す)とは、離れたピーク(橙色矢印↓)を形成していた。図4の横軸は、mRNAレベルの自然対数、縦軸は、各mRNAレベルの出現頻度を表す。橙色矢印で示した、新たに見つかった高発現域のピークには、180個の遺伝子が含まれていた。そのうち、約70%が、リボソームタンパク質遺伝子(橙色で示す)で、ピークには、リボソームタンパク質遺伝子の約90%が含まれていた。
図4で示した例では、リボソームタンパク質遺伝子のmRNAは、全タンパク質(リボソームを含む)から転写される全mRNAの約46%を占めていた。つまり、全mRNAのうち、たった3%しかないリボソーム遺伝子から転写されるmRNAが約半分を占めていることになる。タンパク質製造工場であるリボソームが、いかに大量消費者でもあるかが分かる。
(3)低窒素環境での分裂酵母細胞の増殖
分裂酵母細胞を増殖可能なぎりぎりの低窒素環境で連続培養し、その細胞状態を高窒素環境で培養した場合と比較した。その結果、細胞サイズが約12%、タンパク質量が約30%、rRNA(リボソームRNA)量が約40%、それぞれ減少していた。一方、増殖速度の低下は5%程度にとどまっており、生存率には、ほとんど変化が見られなかった。細胞は、低窒素に応じて、やせる(減量する)ことで増殖の低下を最小限に食い止めようとしていることが示唆された。
(4)低窒素環境で培養した細胞では、リボソームタンパク質遺伝子のレベルが低下していた。
高窒素環境(図5青色)と低窒素環境(同、橙色)との間で、相対的遺伝子発現レベルを比較すると、非リボソームタンパク質遺伝子群に大きな変化は見られなかった。一方、リボソームタンパク質遺伝子では、分布のピーク(図5、矢印↓↓)が、高窒素環境に比べ、わずかに左方に移動していた。これは、リボソームタンパク質遺伝子の発現が、低窒素環境で選択的に低下することを示している。
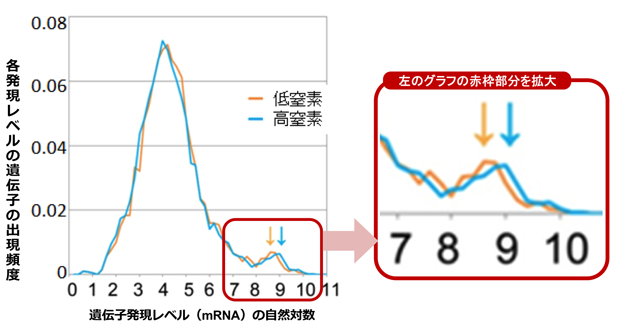
図5 低窒素環境では、高発現域のピークがわずかに左方に移動する
実際に、DNAマイクロアレイによる計測結果から求められる全mRNAに占めるリボソームタンパク質遺伝子のmRNAの割合は、高窒素環境の場合が0.46であるのに対し、低窒素環境の場合には、0.42へと減少していた。この結果は、低窒素環境になった細胞ではリボソーム合成を減らし、浮いた分をその他のタンパク質の合成に回すことで、増殖状態を最適化しようとしていると考えることができる。
用語解説
酵母の一種。学名、Schizosaccharomyces pombe。通常、一倍体で生育し、染色体数は3本。タンパク質をコードする遺伝子数は約5,000個で、染色体数、遺伝子数とも真核生物としては少なく、染色体や細胞分裂のモデル生物として広く研究されている。
数千から数万のDNA断片をガラスなどの基盤上に固定配置した核酸の分析器材。細胞から抽出したRNAやDNA量を配列断片ごとに定量することが可能で、遺伝子発現レベルやDNA結合タンパク質の分布、染色体DNAの核型分析などの測定に用いられる。
約80個のタンパク質(リボソームタンパク質)と4個のRNA(リボソームRNA: rRNA)から成るRNA-タンパク質複合体で、mRNAの塩基配列に基づいてアミノ酸を連結しタンパク質を合成する細胞内装置として働く。
遺伝子が発現するとき、最初にDNAの配列情報がRNAに写し取られる。このとき作られるRNAのことを、DNA情報を伝えるRNAという意味でメッセンジャーRNA(mRNA)と呼ぶ。
通常の培養では、細胞が増殖するにつれて栄養を使い果たしてしまい、培養条件は必ずしも一定に保たれていない。それに対して、連続培養は、新しい培養液を培養槽へ連続的に供給する一方、培養槽内にある培養液を同量吸い出すことによって、培養槽内の成分組成を一定に保った状態で培養を行う方法である。新しい培養液の供給と使用済みの培養液の吸出を同時かつ連続的に行うことで、培養槽内の栄養濃度と培養槽内の細胞濃度は一定に保たれる。
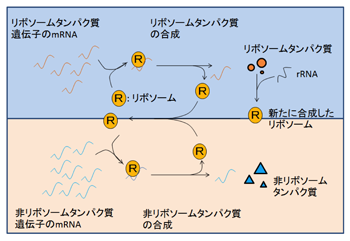
図2 リボソームタンパク質と非リボソームタンパク質の合成
リボソームは、タンパク質を製造する「工場」であり、細胞が合成できるタンパク質の量はリボソームの数に依存する。一方、リボソーム自体がリボソームタンパク質と呼ばれる一群のタンパク質でできているので、リボソームは、タンパク質の製造工場であると同時に工場を利用する大口の消費者でもある。たくさんのリボソームを有することは、それだけ多くのタンパク質を合成できることになるが、多数のリボソームを維持するには、それだけ多くのリソースをリボソーム合成に消費することになり、多過ぎるリボソームは、かえって細胞にとって負担となる。リボソームタンパク質と非リボソームタンパク質の合成割合(図2の上側の反応と下側の反応の割合)、言い換えれば、リボソームのうちのどれだけを「工場」製造に、どれだけを「製品」作製に充てるかということが、増殖を最適化する上で重要となる。
本件に関する問い合わせ先
未来ICT研究所
バイオICT研究室
バイオICT研究室
近重 裕次
Tel: 078-969-2240
E-mail: 


広報
広報部 報道担当
廣田 幸子
Tel: 042-327-6923
Fax: 042-327-7587
E-mail: