国立研究開発法人情報通信研究機構
2016年7月27日
ポイント
- 細胞骨格のダイナミクスを試験管内と計算機内でシミュレーションすることに成功
- 微小管とキネシンが様々なネットワーク構造を作り、大域的な収縮を起こすことを発見
- 細胞・組織・器官の形態を人為的に制御する技術の開発に貢献するもの
NICT 未来ICT研究所の大岩 和弘主管研究員、鳥澤 嵩征研究員及び明治大学理工学部の石原 秀至准教授、谷口 大相研究員の研究グループは、微小管とタンパク質モータ・キネシンが自己組織的に形成するネットワークの振る舞いを定量的に明らかにして、その数理モデル化に成功しました。
微小管とキネシンは、細胞の形態形成、細胞分裂や細胞内物質輸送などの重要な生命機能の基盤を担う細胞骨格の主要要素です。このネットワークの動態観察システムの構築と理論モデルの確立は、生命現象の様々な場面で現れる細胞内秩序構造の形成メカニズムの解明とその秩序構造の操作技術につながることが期待されます。この成果は、「Biophysical Journal」2016年7月26日号(電子版: 米国東部時間7月26日(火)正午)に発表され、その表紙を飾ります。
本研究は、国立研究開発法人科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)「生命動態の理解と制御のための基盤技術の創出」研究領域における研究課題「細胞間接着・骨格の秩序形成メカニズムの解明と上皮バリア操作技術の開発」(研究代表者: 月田 早智子)として実施したものです。
背景

図1 微小管とキネシンが創出したネットワーク構造
星状体の中心にキネシンが集積している。
真核生物の細胞の中には、チューブリンやアクチンと呼ばれるタンパク質が重合してできたフィラメントが張り巡らされて「細胞骨格」と呼ばれる構造を作っています。この細胞骨格は、様々な生命機能において重要な役割を担っています。重合したフィラメントは、それぞれ微小管とアクチンフィラメントと呼ばれます。アクチンフィラメントは、細胞が移動する際に伸長する葉状仮足や細胞が分裂する際の分裂帯に現れ、微小管は、細胞分裂の際に現れる紡錘体や繊毛上皮細胞の細胞膜直下に見られる網目状構造などの広範囲にわたる秩序構造形成に大きな役割を果たしています。これらの細胞骨格に関しては、様々な角度から国際的にも精力的な研究が行われてきました。しかし、細胞骨格の動態という観点では、アクチンフィラメントに関するものが主であり、微小管とその関連タンパク質によるダイナミクスに関する研究は、限定的であり、網羅的に研究されたものはありませんでした。
今回の成果
今回、私たち研究チームは、わずか二種類のタンパク質要素、タンパク質モータ・キネシン(キネシン-5)と微小管を、一定の比率で混合してエネルギー源であるATP(アデノシン三リン酸)を加えるだけで、自発的に様々な空間的秩序構造を創り出すことを見いだしました。10マイクロメートルほどの長さしかない微小管が、キネシン-5と相互作用することで、1000倍に及ぶセンチメートルサイズの実験槽全域に広がる安定なネットワークを形成し(図1参照)、それが大域的な収縮を起こして崩壊することなど、これまで報告されていなかった現象を発見しました。また、分子生物学的に改変を加えて収縮力の強化を行った変異体キネシン-5が、微小管が放射状に突き出した星状体を多数出現させるという新しい構造ダイナミクスを明らかにしました。さらに、これらの結果を再現する理論モデルを構築、タンパク質モータの「フィラメントを束化する能力」と「滑り運動能」がネットワーク構築に影響することを定量的に示し、その影響を予見することができるようになりました(図2参照)。
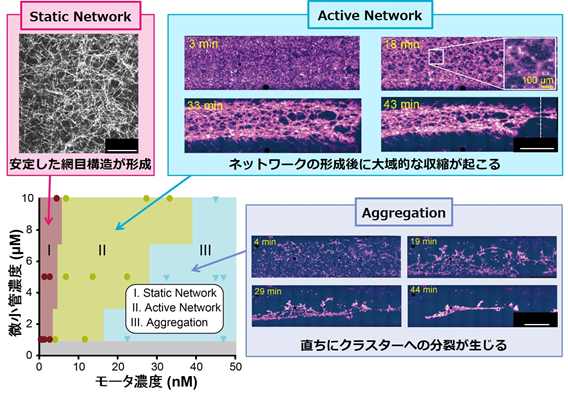
図2 様々な比で混合した微小管とキネシンが創り出すネットワーク構造の相図
今後の展望
細胞骨格のダイナミクスは、細胞の形や振る舞いに影響を与えるだけではなく、細胞集団である組織の形や組織の機能へも影響を与えるものです。わずか二種類のタンパク質の濃度と特性を改変するだけで、細胞骨格の動態を大きく変えられる可能性を示し、その数理モデル化に成功したことで、細胞の機能改変や組織構造変化などの人為的操作を簡潔に行うための技術開発につながるものと期待できます。
Biophysical Journal
2016年7月26日号
URL: http://www.cell.com/biophysj/
掲載論文名:Spontaneous formation of a globally connected contractile network in a microtubule-motor system
著者:Takayuki Torisawa, Daisuke Taniguchi, Shuji Ishihara and Kazuhiro Oiwa
2016年7月26日号
URL: http://www.cell.com/biophysj/
掲載論文名:Spontaneous formation of a globally connected contractile network in a microtubule-motor system
著者:Takayuki Torisawa, Daisuke Taniguchi, Shuji Ishihara and Kazuhiro Oiwa
(鳥澤 嵩征(NICT)、谷口 大相(明治大学理工学部)、石原 秀至(明治大学理工学部)、大岩 和弘(NICT))
各著者の役割
本論文への鳥澤と谷口の貢献は同等であり、両者は筆頭著者です。また、大岩、鳥澤、谷口が本研究を設計企画、鳥澤が実験を実施しました。谷口と石原は、数理モデル化とシミュレーションデザインを行い、谷口、鳥澤、石原が、シミュレーションを実施しました。得られたデータの解釈と論文執筆は著者全員で行いました。
補足資料
微小管-キネシン相互作用によるネットワーク形成とその数理モデル化
【研究の背景と目的】
細胞は、ダイナミックにその形を変えて、様々な生命活動を行います。この細胞のダイナミックな構造変化は、細胞の骨組みとして働いている「細胞骨格」と呼ばれるタンパク質フィラメントと、それに結合するタンパク質群によって行われています。細胞骨格は、重合と脱重合を繰り返すことによってダイナミックにその形を変えますが、同時にフィラメントに結合するタンパク質の働きによっても変化します。図4に示す例のように、細胞分裂時には、染色体を娘細胞に分ける働きを持つ有糸分裂紡錘体が微小管のネットワークから創出してきます。また、細胞分裂において細胞をくびりきるのはアクチンフィラメントの働きです。また、細胞の中央から端に向けて様々な物質を輸送したり、筋肉を収縮したりするのは、タンパク質モータ(ミオシン、キネシン、ダイニン)がタンパク質フィラメントと共に働く結果生じる現象です。このような細胞骨格とそのダイナミクスを創り出す基本的原理を明らかにすることは、細胞の形態変化、ひいては細胞の集団である組織・器官の形態形成の原理の解明につながり、それを操作する技術の開発にもつながる可能性を持った研究です。
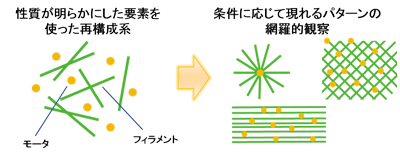
図5 微小管とタンパク質モータの混合によって創出される構造の網羅的検索
これまで数十年にわたって、微小管、アクチンフィラメントとタンパク質モータの個々の特性を明らかにする研究が精力的になされてきました。私たちの研究グループもその進展に大きく貢献してきました。その結果、これらのタンパク質の最も重要な特性が明らかにされてきました。しかし、細胞骨格のダイナミクスを理解するためには、これらの部品がどのように互いに連携するかということを詳細に理解することが必要です。今回、私たちのグループは、タンパク質モータと微小管によって形成された微小管ネットワークがその混合比を変えることで様々な形態を示すことを定量的に示し、この数理モデル化に成功しました(図5参照)。
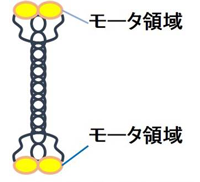
図6 キネシン-5の分子構造の模式図
【研究成果】
数理モデル化と実験系の対応を付けやすくするために、微小管ネットワークは最少のタンパク質要素で構築することにしました。精製した微小管とタンパク質モータ(キネシンの一種であるキネシン-5)です(図6参照)。キネシン-5は、微小管のプラス端に向かってそれ自身が動いていきます。また4つあるモータ領域を使って、微小管同士を架橋する働きを持っています。エネルギー源はATP(アデノシン三リン酸)で、これが溶液中にあると、ATPを結合してこれを加水分解し、そのエネルギーを使って微小管同士を滑らせたり、キネシン-5自身を微小管のプラス端に集積させます。この結果、少量のキネシン-5と微小管は、ATP存在下で星状体(微小管を放射状に伸ばした星のような形状をした構造体)を形成します(図8参照)。
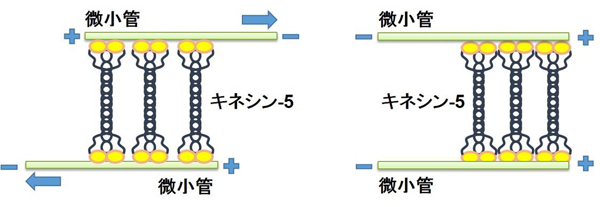
図7. キネシン-5と微小管との相互作用の形態
極性の異なる微小管を束化すると同時に滑らせる。
極性の揃った微小管の場合、キネシン-5自身が微小管のプラス端に集積する。
このような振る舞いが、大域的な振る舞いの素過程にある。
さらに、大きな構造変化を想定して、ミリメートルにも広がる実験槽を準備して実験を行いました。微小管束化能力と滑り運動を起こす能力を兼ね備えるキネシン-5 と微小管を混合して、その混合比、濃度などのパラメータを変化させることで相変化を引き起こし、この秩序化の相図を詳細に記載しました(図2参照)。
微小管のプラス端に集積して星状体構造を形成するキネシン-5は、その濃度が低い場合には、星状体同士を接続するものの全体構造は変化させません(静的ネットワーク)。しかし、キネシン-5の濃度を上げると、微小管ネットワーク全体はゆっくり縮み始め、やがて、ネットワークの一部が崩壊して急激な収縮を生じます。微小管より200倍も柔軟で、比較的短いフィラメントでできているアクチンフィラメントのネットワークでは、このような収縮はマイクロメートル・スケールで頻繁に観察され報告されてきました。しかし、直線的な構造、星状体のような放射状構造を作る傾向にある微小管での収縮の機構は、そのサイズはアクチンの場合と大きく異なっています。ミリメートルに広がる実験槽の中をくまなく観察することで、微小管ネットワーク全体が収縮することを観察できたのです。この収縮性は、微小管の端をしっかりとつかんでいるタンパク質モータの濃度と力学特性に依存します。モータの特性を変えた場合には、均一で小さな星状体が実験槽全面に分散して形成されることを確認しました。これら観察は、タンパク質フィラメントの収縮性の一般原則を明らかにする上で、新たな知見を与えたものと考えられます。また、キネシン-5によるネットワーク全体の収縮は、紡錘体の挙動を理解する上でも重要です。なぜならば、このキネシンは、細胞分裂における紡錘体の形成や伸長に働くとされているからです。今回観察された収縮は、紡錘体形成や紡錘体伸長で生じている現象を再現している可能性があります。
【数理モデル構築】
理論モデルの構築は、明治大学理工学部の石原准教授のグループとNICTが連携して進め、ネットワーク全体の挙動をわずか3つの局所ルールを与えたアクティブネットワークの理論で説明しました(図8参照)。このモデルのパラメータと実体レベルのパラメータとの整合性を確認しました(図9参照)。また、モータ特性の変調がネットワーク構造に与える影響について、高い予見性を示しています。先に述べた星状体形成を予見できているのです。このように、ネットワーク全体の挙動をわずか3つの局所ルールで説明できたことは、細胞骨格操作という観点からみると重要な進展と考えられます。例えば、この理論を使うと、微小管密度がどのようにネットワークの形状に影響を与えるか、モータの微小管への親和性がネットワークの形状にどのように影響するかなどを説明することができます。細胞骨格ネットワークの構造ダイナミクスについての進歩は、実験と理論の間で行う相互理解とフィードバックを通して大きく進展することが期待できます。
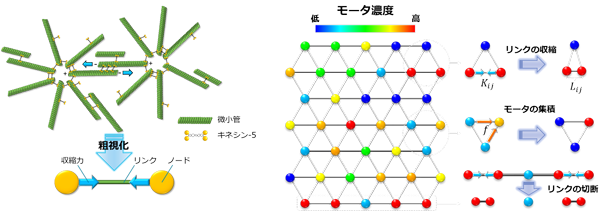
図8 数理モデル構築のための、微小管-キネシンネットワークの粗視化とノードとリンクへのダイナミクスの導入

図9 観察された4つの微小管ネットワークの動態を数理モデルで再現
静的ネットワーク、動的収縮ネットワーク、凝集体形成、星状体形成が見事に再現された。
用語解説
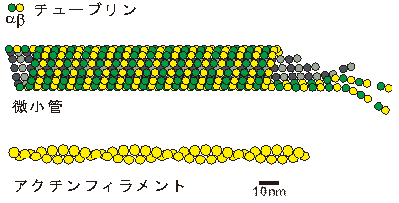
図3 細胞骨格を構成する主なタンパク質フィラメントである微小管とアクチン微小管は筒状の構造を持っている。
真核生物において、細胞分裂や物質輸送、神経細胞などの形態形成の基盤となる構造を形成しているタンパク質フィラメント。αとβの二種類の単量体チューブリンが結合したαβユニットが連なってプロトフィラメントを形成し、これがチューブ状に丸まることで筒状構造を作る。微小管の両端にαβユニットが更に結合することによって、微小管の伸長が生じる。重合が活発に生じる端をプラス端、その反対側をマイナス端と呼ぶ。
細胞内では、中心体と呼ばれる構造から伸長した微小管が細胞周囲に向かって放射状に伸びており、タンパク質モータは、この微小管をレールとして物質輸送を行っている。細胞分裂の際には、微小管は、紡錘体と呼ばれる構造に形を変えて、娘細胞への染色体の正しい分配に必要不可欠な寄与をしている。
生物の運動の原動力となっているタンパク質。ATP(アデノシン三リン酸)を加水分解したときに得られるエネルギーを使って、微小管やアクチンフィラメントなどの輸送路となるタンパク質フィラメントの上を運動することができる。代表的なタンパク質モータは、筋肉の収縮の原動力であるミオシン、細胞内の物質輸送に関わるキネシン、物質輸送と繊毛・鞭毛の運動を作り出すダイニンがある。NICTでは、このダイニンに関する研究で多くの成果を挙げている。
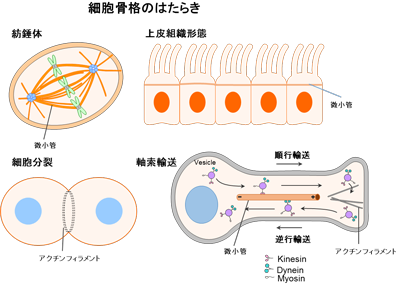
図4 細胞に見られる様々な細胞骨格の例
微小管とアクチンフィラメントがネットワーク構造を形成して、
様々な生命活動に関わる動的な細胞骨格を提供している。
様々な生命活動に関わる動的な細胞骨格を提供している。
細胞の形や運動に関わる細胞内のタンパク質フィラメントとその結合タンパク質によってできている骨組み構造。動的にその構造を変化させる。細胞分裂の際の収縮環や紡錘体を形成、細胞内の物質輸送や上皮細胞の形やその組織形成などにも関わる。生命現象の基本的過程に関わる重要な構造であり、その主要な構造タンパク質は、微小管とアクチンフィラメント、中間径フィラメントである。これらのフィラメントと相互作用するタンパク質モータや結合タンパク質によって、動的な骨組みが形成されている。
細胞質で働くタンパク質モータの一種であり、微小管上を運動する。細胞内での物質輸送や細胞分裂時の紡錘体の形成、維持などに寄与していることが知られている。通常、ATPの加水分解部位と微小管結合部位を併せ持つモータードメイン2つがコイルドコイルドメインを介して二量体化した運動ユニットを1つ有しており、この2つのモータードメインの微小管に対する協調的な結合解離を通じて微小管上を運動する。たくさんの種類があるキネシンの中でキネシン-5は、主に細胞分裂期に働くキネシンであり、2つのモータードメインが二量体化した運動ユニットが、更にコイルドコイルを通じてつながることで四量体を形成している。
本件に関する問い合わせ先
未来ICT研究所
フロンティア創造総合研究室
フロンティア創造総合研究室
鳥澤 嵩征、大岩 和弘
Tel: 078-969-2112
E-mail: 



E-mail: 


広報
広報部 報道室
廣田 幸子
Tel: 042-327-6923
Fax: 042-327-7587
E-mail: