モータータンパク質は種類により協働性が異なることを発見
—分子を自在に並べる技術により生体分子モーターの協働性を計測—
2020年1月23日
国立研究開発法人情報通信研究機構
国立大学法人京都大学
概要

1.背景
2.研究手法・成果

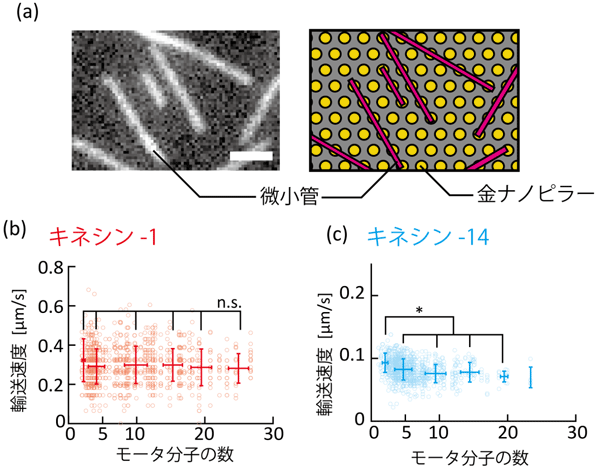
3.波及効果、今後の予定
4.資料提供
5.研究プロジェクトについて
研究者のコメント
論文タイトルと著者
お問い合わせ先
京都大学大学院工学研究科 マイクロエンジニアリング専攻
横川隆司(よこかわ・りゅうじ)
E-mail:

























