受精卵の中で人工細胞核構造の構築に世界で初めて成功
細胞核が形成される仕組みの一端を明らかに
2019年6月11日
情報通信研究機構
近畿大学
大阪大学
1. 本件のポイント
2. 本件の内容
3. 掲載誌について
4. 研究の背景
5. 研究の詳細
(1)マウス受精卵へのDNAビーズ導入法の確立
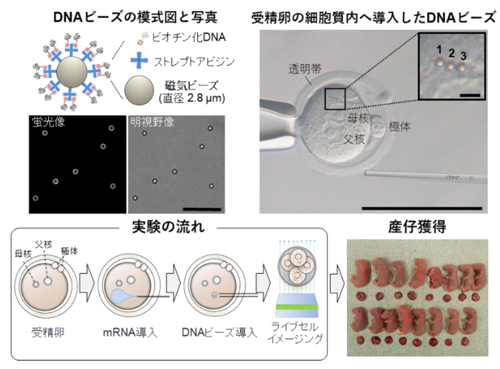
(2)DNAビーズ周囲へのヒストン集積およびヌクレオソーム構造の観察
(3)DNAビーズ周囲の核膜および核膜孔様構造の観察
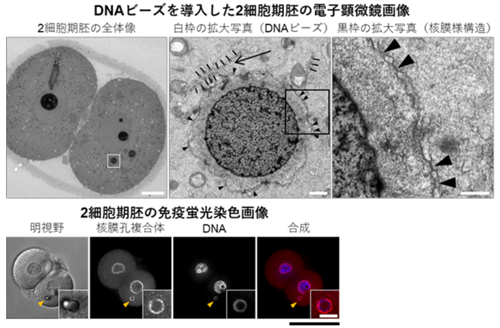
(4)人工核様構造の核移行活性評価
6. 今後の展望
7. 用語解説
本件に関する問い合わせ先
近畿大学 総務部 広報室
担当:髙橋、村尾
Tel:06-4307-3007 FAX:06-6727-5288
E-mail:
















情報通信研究機構 広報部 報道室
廣田
Tel: 042-327-6923 FAX: 042-327-7587
E-mail:



















大阪大学 大学院生命機能研究科
教授 平岡泰(ひらおか やすし)
Tel: 06-6879-4620 Fax: 06-6879-4622
E-mail: